近日,西北工业大学医学院研究院博士研究生姜文华以第一作者、西北工业大学医学研究院为第一作者单位,在国际著名医学期刊《Free Radical Biology and Medicine》发表了题为“MG53 inhibits ferroptosis by targeting the p53/SLC7A11/GPX4 pathway to alleviate doxorubicin-induced cardiotoxicity”的研究论文,阐明了MG53(Mitsugumin-53)在阿霉素(DOX)诱导的心肌细胞铁死亡中的详细作用,这是一个先前研究中未充分阐明的新机制。同时,该项研究也是张子绘副教授围绕心肌细胞铁死亡机制,在《Free Radical Biology and Medicine》发表的第二篇系列研究成果。

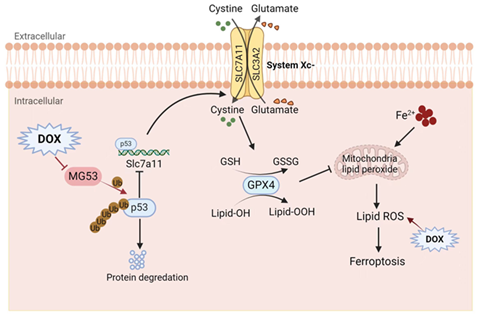
阿霉素(Doxorubicin, DOX),一种广泛使用的化疗药物,其心脏毒性限制了临床应用。尽管阿霉素诱导的心肌毒性(doxorubicin-induced cardiotoxicity, DIC)与铁死亡密切相关,但心肌细胞铁死亡的分子机制在很大程度上仍是未知的。MG53(Mitsugumin-53 或 TRIM72),作为细胞膜修复中的关键肌源性因子,在缺血心脏保护中起着重要作用;并且,MG53作为E3泛素连接酶参与多种生物过程和信号通路的调控。然而, MG53在DIC中的作用及其机制尚待阐明。
p53介导的铁稳态和氧化还原失衡是DOX诱导的心肌铁死亡重要机制之一,该研究深入探索了MG53作为E3泛素连接酶对p53降解的调控作用。通过生物信息学、离体和在体实验发现p53是MG53的新底物分子,而DOX降低了二者的结合和p53泛素化。心肌细胞MG53过表达增加了DOX暴露下p53的泛素化水平,免疫共沉淀实验表明MG53介导K48依赖的p53多泛素化。相反,无E3酶活性MG53突变体,MG53(C14A)和MG53(D-RING)均无法促进p53泛素化,这些结果表明MG53调控p53的泛素化降解。最终,研究者在细胞和动物模型中验证了MG53过表达通过调节p53/SLC7A11/GPX4信号通路抑制DOX诱导的心肌细胞铁死亡。该研究为理解DOX心肌毒性提供了新的视角,揭示了MG53作为E3泛素连接酶在调控p53蛋白降解中的作用,这一发现为心肌细胞特异性保护机制提供了新的分子层面的见解。此研究提出了靶向MG53作为治疗阿霉素诱导的心肌毒性(DIC)的新策略,这为临床治疗提供了新的方向。
西北工业大学医学研究院博士生姜文华为该论文的第一作者,西北工业大学医学研究院特聘研究员、空军军医大学马恒教授为论文的通讯作者、西北工业大学医学研究院张子绘副教授为论文的共同通讯作者。该工作得到了国家自然科学基金、国家重点研发计划、西北工业大学博士论文创新基金等多个项目的支持。
近年来,医学研究院充分发挥校外讲座教授、特聘研究员的指导作用,聚焦科学前沿,在科研实践中培育和凝聚人才。这在研究生培养和带动专业人才发展中获得了增效提速的显著成绩。
原文链接:https://www.sciencedirect.com/science/article/abs/pii/S0891584924005872



 医学研究院
医学研究院
 西北工业大学
西北工业大学