近日,国际顶级期刊Nature Communication(《自然·通讯》)在线发表了西北工业大学医学研究院戴亮亮副教授(ORCID ID:0000-0002-2041-9357)在功能纳米药物递送系统肿瘤生物免疫治疗领域取得突破“Multifunctional metal-organic framework-based nanoreactor for starvation/oxidation improved indoleamine 2,3-dioxygenase-blockade tumor immunotherapy”。研究团队发现构建的Mn基可降解MOF纳米反应器药控体系,通过共负载葡萄糖氧化酶(GOx)和IDO免疫抑制剂1-MT,不仅能有效介导肿瘤饥饿和氧化损伤,同时还能调控增强机体免疫应答,具有良好的生物安全性、级联放大机体抗肿瘤免疫应答水平、激活机体二次免疫记忆功能、以及有效的抑制肿瘤生长、转移及复发等优势,相关研究成果发表于国际顶级学术期刊Nature Communication(2022, DOI:10.1038/s41467-022-30436-y)。
全文链接:https://www.nature.com/articles/s41467-022-30436-y。

肿瘤抑制性免疫微环境和低水平的体内药物递送抑制了肿瘤饥饿治疗疗效。本研究以ROS响应性可降解Mn基MOF为载体,共负载葡萄糖氧化酶 (GOx) 和 IDO 抑制剂 1-甲基色氨酸,设计构建一类肿瘤自响应性MOF纳米反应器药物控释系统,级联放大药物释放,调控肿瘤饥饿联合免疫治疗。首先,该体系应答于肿瘤弱酸性微环境,激活载体尺寸减小和电荷反转策略,有效提高肿瘤渗透深度、细胞摄取效率及药物的生物利用度。其次,该控释体系响应瘤内活性氧 (ROS) ,快速降解并释放负载药物。在此期间,释放的GOx竞争性消耗葡萄糖并产生ROS,既能饥饿肿瘤并促进其氧化损伤,又能联放大MOF解体和药物释放。而释放的1-MT能显著性抑制IDO活性,抑制免疫耐受。最后,该体系不仅通过GOx激活的肿瘤饥饿/氧化治疗,杀伤肿瘤,增强肿瘤免疫原性,进而募集大量效应T细胞浸润到肿瘤病灶,显著增强免疫应答,而且通过抑制IDO活性,阻断免疫免疫逃逸。二者协同互作,有效提高体内外肿瘤治疗效果。
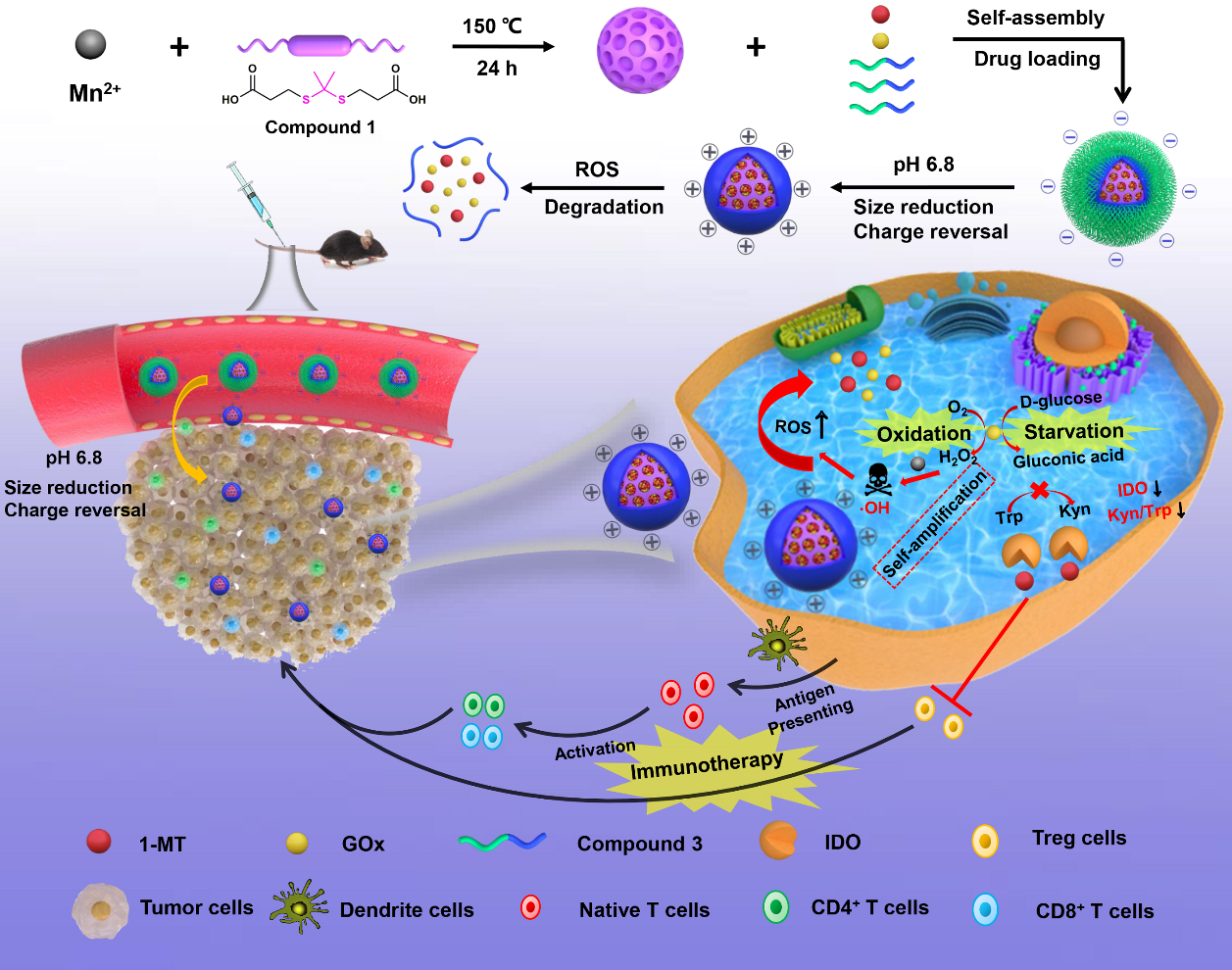
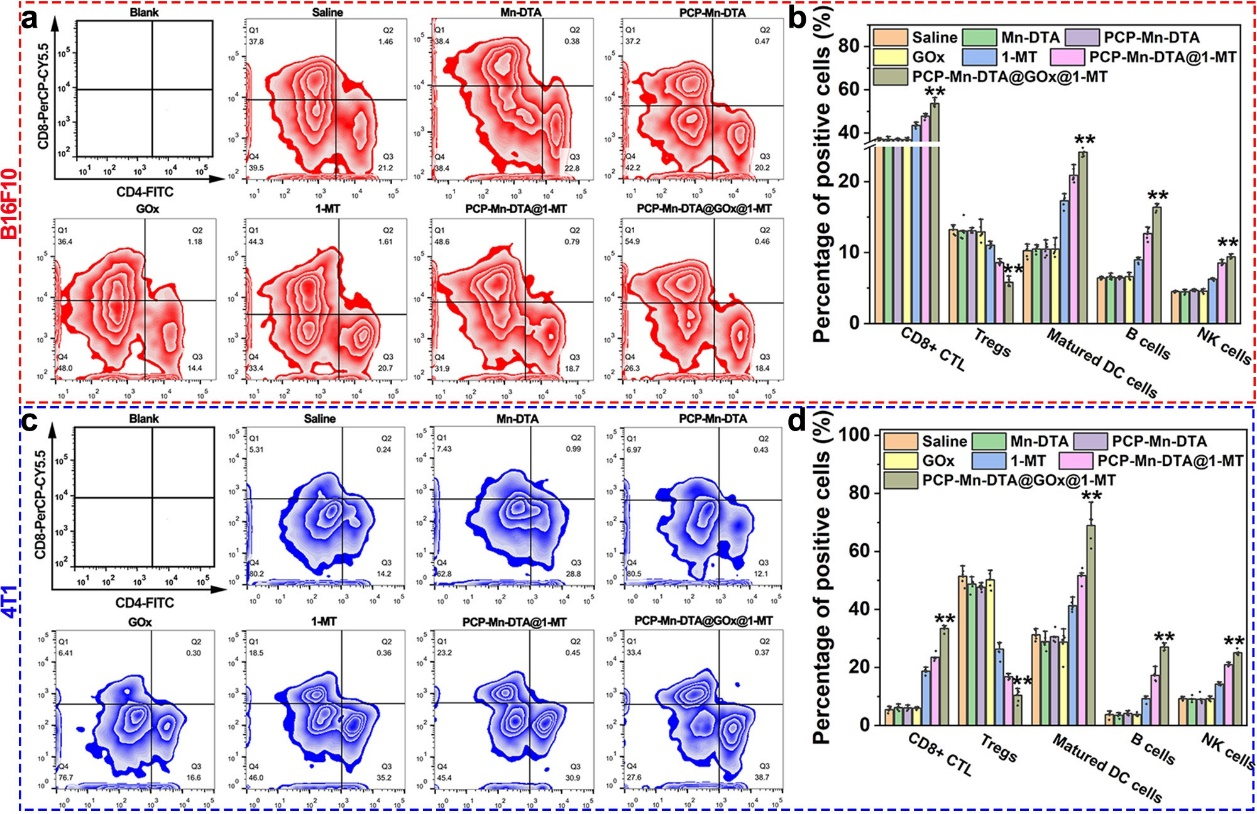
体内外实验结果表明,本研究构建的MOF纳米反应器药控体系介导的肿瘤饥饿/免疫联合治疗策略在荷B16F10黑色素瘤的C57BL/6和荷4T1乳腺癌的Balb/c两类免疫小鼠肿瘤模型中,均显著性增强了机体的抗肿瘤免疫应答水平,并激活了机体的二次免疫记忆功能,进而能长效的抑制体内肿瘤的生长、转移和复发,具有良好的生物安全性和潜在的临在的临床应用前景。
本论文的第一作者为戴亮亮副教授,杨慧教授、蔡开勇教授(重庆大学)、赵彦利教授(南洋理工大学)为共同通讯作者。该研究工作得到国家自然科学基金、科技部重点研发计划、陕西省重点研发计划、西北工业大学“翱翔新星”等项目的支持。详见课题组主页:https://teacher.nwpu.edu.cn/8DD05D57882C439588AD4BBED91B1785.html。



 医学研究院
医学研究院
 西北工业大学
西北工业大学